Diagnóstico de la FPI
La fibrosis pulmonar idiopática (FPI) se define como un tipo específico de neumonía intersticial fibrosante crónica y progresiva, limitada al pulmón, de causa desconocida, que afecta generalmente a mayores de 50 años y se asocia al patrón radiológico y/o histológico de la neumonía intersticial usual (NIU).1,2
El diagnóstico de FPI requiere que se cumplan dos criterios:1,2
- La exclusión de otras causas de enfermedad pulmonar intersticial (exposición ambiental u ocupacional, enfermedades del tejido conectivo y toxicidad por fármacos).
- La presencia de un patrón radiológico de NIU en la tomografía axial computarizada de alta resolución (TCAR), o del patrón histológico de NIU en muestras de la biopsia pulmonar, o de ambos.
Por otro lado, la precisión diagnóstica aumenta cuando la evaluación la realiza un equipo multidisciplinar compuesto por neumólogos, radiólogos y patólogos expertos en el diagnóstico y manejo de las enfermedades pulmonares intersticiales. Esta recomendación, ampliamente aceptada en las guías de diagnóstico de la FPI, es especialmente importante en los casos en los que existe una discordancia entre los patrones radiológicos e histopatológicos.1-4
Evaluación de la fibrosis pulmonar idiopática (FPI)
La evaluación de un paciente en el que se sospecha una FPI consta de la anamnesis y la exploración física, pruebas de laboratorio, pruebas de función pulmonar y pruebas de imagen. Puede ser necesario realizar una biopsia pulmonar y un lavado broncoalveolar. Además, en la actualidad se están estudiando diversos biomarcadores.5
Anamnesis en la fibrosis pulmonar idiopática
El diagnóstico de la fibrosis pulmonar idiopática comienza con una adecuada anamnesis. Como en todo paciente en el cual se sospeche una enfermedad pulmonar intersticial difusa (EPID), debe preguntarse acerca de los antecedentes familiares de enfermedades pulmonares, síntomas sugerentes de enfermedades reumatológicas (artralgias, sequedad ocular y oral, debilidad muscular, fenómeno de Raynaud, hormigueo, etc.), toma de medicamentos, exposiciones ocupacionales y ambientales, y tratamiento con radioterapia.3
Exploración física en la fibrosis pulmonar idiopática
En la exploración física se prestará especial atención a la auscultación, pues en el 90 % de los pacientes se escucharán crepitantes en velcro bilaterales. La mitad de los pacientes tendrán acropaquias.2
Pruebas de laboratorio en la fibrosis pulmonar idiopática
No existen alteraciones de laboratorio específicas de la FPI. Sin embargo, dado que el patrón de neumonía intersticial usual puede aparecer en las enfermedades del tejido conectivo, siempre se deben realizar determinaciones serológicas, incluso en ausencia de síntomas y signos sugerentes de esas enfermedades.2
Pruebas serológicas
Las pruebas serológicas deben incluir los anticuerpos antinucleares (presentes entre el 17 % y el 25 % de los pacientes con FPI), el factor reumatoide (que se encuentra entre el 5 % y el 18 %) y los anticuerpos contra los péptidos cíclicos citrulinados.1,5
Otras pruebas serológicas más específicas, como los anticuerpos antisintetasa (anti-Jo-1), la creatina- cinasa, la aldolasa, los anticuerpos de la enfermedad de Sjögren (anti-SSA, anti-SSB) y los anticuerpos de la esclerosis sistémica (antitopoisomerasa [scl-70], anti-PM-1) solo deben determinarse en casos seleccionados.1
IgG específicas
Una cuestión controvertida es si se deben o no determinar en el suero las IgG específicas frente a los antígenos que con más frecuencia causan neumonitis por hipersensibilidad.
Hay quienes abogan por investigarlos siempre, debido a que las manifestaciones de ambas enfermedades son en ocasiones similares2 y a que el diagnóstico de la neumonitis por hipersensibilidad puede pasar desapercibido si no se efectúa un estudio exhaustivo.6 Sin embargo, la utilidad de estas pruebas en el diagnóstico de la FPI queda limitada por problemas de especificidad, por lo que hay quienes las reservan para pacientes con factores de riesgo (por ejemplo, la exposición laboral o ambiental a alguna sustancia) o manifestaciones clínicas atípicas (por ejemplo, edad de inicio temprana o nódulos centrolobulillares en la TCAR).5
Pruebas de función pulmonar en la fibrosis pulmonar idiopática
Son pruebas de rutina en todos los pacientes en los que se sospeche una enfermedad pulmonar intersticial. En la espirometría de la FPI se encuentra un patrón restrictivo, sobre todo debido a la disminución de la capacidad vital forzada (CVF). En otras pruebas funcionales respiratorias se halla una disminución de la difusión pulmonar para el monóxido de carbono (DLCO) y, en fases avanzadas, una limitación en la prueba de la marcha de 6 minutos.5
Las pruebas funcionales respiratorias son importantes para evaluar el grado de deterioro de la función pulmonar en el momento del diagnóstico y durante el control evolutivo del paciente. Por otro lado, el descenso de la CVF es la medida de la función pulmonar que mejor predice la mortalidad.8
Lavado broncoalveolar en la fibrosis pulmonar idiopática
El lavado broncoalveolar (LBA) en la FPI suele mostrar una neutrofilia leve, con o sin eosinofilia. En general, esta técnica tiene un papel limitado en el diagnóstico de la FPI. Su principal utilidad es descartar la neumonitis por hipersensibilidad crónica (linfocitosis >40 %).
El consenso internacional del 20111 indica que el LBA con recuento celular no está indicado de forma sistemática en todos los pacientes con sospecha de FPI, aunque puede ser apropiado en una minoría. En la práctica, esta recomendación es confusa,9 y hay quien propone realizarlo en todos los casos.6
Pruebas de imagen en la fibrosis pulmonar idiopática
Radiografía de tórax
En la radiografía de tórax se observa un patrón reticular, que puede estar asociado a imágenes en panal, distribuido en las bases pulmonares y en la periferia. Si existen imágenes alveolares, se debe sospechar otro diagnóstico. Estas alteraciones no son específicas de la FPI y aparecen también en otras EPID.
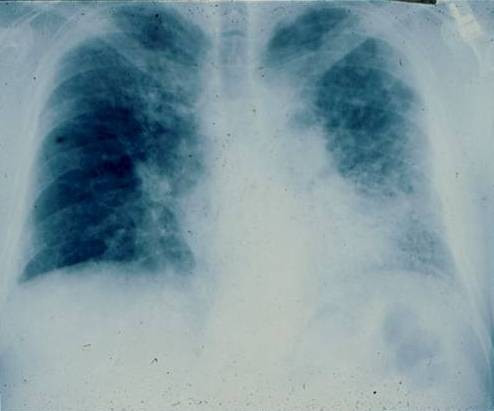
Figura 1. Radiografía simple de un paciente con fibrosis pulmonar idiopática (FPI). Patrón reticular de predominio en las bases.
Tomografía computarizada de alta resolución (TCAR)
Es una prueba esencial para el diagnóstico de la FPI. Puede ser de adquisición secuencial o de adquisición volumétrica. Es preferible la segunda, ya que mejora la caracterización de las alteraciones, pero la dosis triplica a la empleada en la secuencial. Actualmente, existen técnicas para reducir las dosis.4
La TCAR en las guías vigentes de la SEPAR y el grupo internacional ATS/ERS/JRS/ALAT
Con la TCAR se busca identificar el patrón típico de la neumonía intersticial usual, que tiene cuatro características1 (figura 3):
- Predominio basal y localización subpleural de las lesiones.
- Reticulación.
- Patrón en panal de abeja (grupos de quistes subpleurales con paredes finas y un diámetro de entre 3 y 10 mm), con o sin bronquiectasias de tracción.
- Ausencia de signos radiológicos discordantes con la NIU (tabla 1).
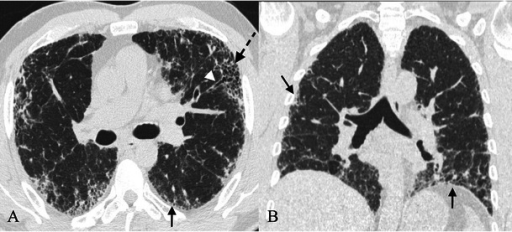
Figura 2. Patrón de neumonía intersticial usual (NIU) en la tomografía computarizada de alta resolución (TCAR). Predominio basal y localización subpleural de las lesiones (flechas negras). Patrón reticular (flechas negras) con bronquiectasias de tracción (punta de flecha blanca). Patrón en panal de abeja (flecha negra discontinua). Ausencia de signos radiológicos discordantes con la NIU.
En la tabla 1 se recogen los criterios para el diagnóstico de la NIU mediante la TCAR, según el grupo de consenso ATS/ERS/JRS/ALAT1 y la SEPAR2. La presencia de zonas en panal de abeja es un criterio imprescindible para diagnosticar con certeza el patrón de NIU en la TCAR1. Sin embargo, puede estar ausente5. En estos casos, el patrón es de posible NIU, y para llegar al diagnóstico definitivo de NIU será necesaria una biopsia. Es decir, la biopsia pulmonar podrá obviarse solo cuando la TCAR muestre un patrón de certeza típico de NIU.1,2
Tabla 1. Criterios diagnósticos de neumonía intersticial usual en la tomografía computarizada de alta resolución1,2
|
Patrón de NIU |
Patrón de posible NIU |
Signos discordantes con la NIU |
|
|
|
NIU: neumonía usual intersticial.
El valor predictivo positivo de la TCAR en el diagnóstico de la NIU es del 90 % al 100 %1. Además de la FPI, otras enfermedades en las que puede identificarse un patrón de NIU son la neumonitis por hipersensibilidad crónica, la asbestosis, algunas enfermedades reumatológicas (por ejemplo, la artritis reumatoide y la esclerosis sistémica) y algunas enfermedades producidas por medicamentos.5
La TCAR también sirve para evaluar las posibles comorbilidades (enfisema, hipertensión pulmonar, cáncer de pulmón) que influyen en el curso clínico de la FPI.2
Propuestas de actualización de las guías
La realidad es que, en la práctica, al aplicar los criterios del consenso internacional del 20111 muchos pacientes quedan incluidos en la categoría de posible NIU6. En este sentido, recientemente se han propuesto nuevos criterios para el diagnóstico de la NIU mediante la TCAR —por ejemplo, eliminar la presencia necesaria de un patrón en panal de abeja—, pero de momento no se han incorporado a las guías clínicas.10
Con este mismo fin de mejorar la precisión diagnóstica de la FPI en los pacientes con un patrón de posible NIU (esto es, sin patrón en panal de abeja) en la TCAR, algunos autores sugieren combinar datos clínicos (edad, sexo, tabaquismo, etc.) y radiológicos (extensión de la reticularidad en relación con el vidrio deslustrado, amplitud de las bronquiectasias de tracción, etc.).11,12
En esa misma línea, la Fleischner Society considera que un patrón de posible NIU (que ellos denominan probable NIU) en un contexto clínico apropiado (pacientes mayores de 60 años, fumadores y que no presentan otras causas potenciales de fibrosis) puede ser suficiente para diagnosticar FPI, sin necesidad de biopsia.4
Además, incluyen una nueva categoría en la clasificación de la NIU mediante TCAR (diagnóstico indeterminado de NIU), con los siguientes criterios:
- Distribución variable o difusa.
- Fibrosis con algunas características poco llamativas sugerentes de un patrón diferente de NIU.
En estos casos, proponen realizar una biopsia para llegar al diagnóstico de FPI.4
Biopsia pulmonar en la fibrosis pulmonar idiopática
Está indicada cuando la evaluación clínica, las pruebas de laboratorio y la TCAR no permiten el diagnóstico de FPI, siempre y cuando los beneficios de obtener un diagnóstico de certeza superen los riesgos del procedimiento.1
La biopsia transbronquial —útil para diagnosticar sarcoidosis, infecciones y tumores— no está indicada cuando se sospecha FPI, ya que la muestra es demasiado pequeña para confirmar el diagnóstico. La biopsia quirúrgica puede efectuarse mediante una toracoscopia o una toracotomía1. La criobiopsia transbronquial es una técnica prometedora en el diagnóstico de las EPID, pero hacen falta más estudios para corroborar su utilidad.2,4,13-15
Deben obtenerse muestras de más de un lóbulo en la biopsia. Es preferible evitar la língula y el lóbulo medio, ya que suelen mostrar cambios inespecíficos2.
El diagnóstico histológico según las guías vigentes de la SEPAR y el grupo internacional ATS/ERS/JRS/ALAT
Según las guías actuales de la SEPAR y el grupo internacional ATS/ERS/JRS/ALAT1,2, el patrón histológico de la NIU se caracteriza por 4 alteraciones1 (figura 4):
- Importante fibrosis o distorsión de la arquitectura pulmonar, con o sin patrón en panal de abeja, de predominio subpleural y paraseptal.
- Afectación parcheada, en la que alternan áreas de fibrosis con otras de pulmón sano.
- Focos fibroblásticos.
- Ausencia de datos histopatológicos discordantes con la NIU, que sugieran otros diagnósticos (tabla 2).
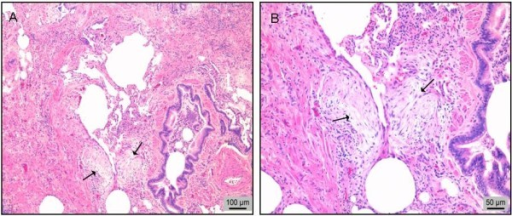
Figura 3. Biopsia pulmonar quirúrgica de un paciente con fibrosis pulmonar idiopática (FPI). A. Patrón histológico de neumonía intersticial usual (NIU): fibrosis, focos de fibroblastos (flechas) y escasas paredes alveolares casi normales (en el centro de la imagen). B. Imagen aumentada de los focos de fibroblastos (flechas). Tinción de hematoxilina-eosina.
Un patrón histológico similar al de la NIU se puede encontrar en otras enfermedades, como la artritis reumatoide, la neumonitis por hipersensibilidad crónica y por fármacos, o la asbestosis.1
Tabla 2. Criterios histopatológicos para el diagnóstico de neumonía intersticial usual1,2
| Patrón de NIU (requiere los 4 criterios) |
|
| Patrón de probable NIU |
O
|
| Patrón de posible NIU (requiere los 3 criterios) |
|
| No hay patrón de NIU (cualquiera de los 6) |
|
NIU: neumonía intersticial usual.
En los casos en los que se ha realizado biopsia, para establecer el diagnóstico de fibrosis pulmonar idiopática se combinan los datos de la TCAR con los histopatológicos1 (tabla 3).
Tabla 3. Combinación de los datos de la tomografía computarizada de alta resolución con los de la biopsia pulmonar en el diagnóstico de la neumonía intersticial usual1,5
|
TACAR |
Biopsia |
Diagnóstico de FPI |
|
NIU |
NIU Probable NIU Posible NIU Fibrosis inclasificable |
SÍ |
|
No NIU |
No |
|
|
Posible NIU |
NIU Probable NIU |
SÍ |
|
Posible NIU Fibrosis inclasificable |
Probable |
|
|
No NIU |
No |
|
|
Discordante con NIU |
NIU |
Posible |
|
Probable NIU Posible NIU Fibrosis inclasificable No NIU |
No |
NIU: neumonía intersticial usual; TACAR: tomografía computarizada de alta resolución; FPI: fibrosis pulmonar idiopática. Las celdas sombreadas indican las combinaciones que llevan al diagnóstico de FPI.
Según todo lo expuesto, el algoritmo diagnóstico de la FPI queda reflejado en la figura 4.
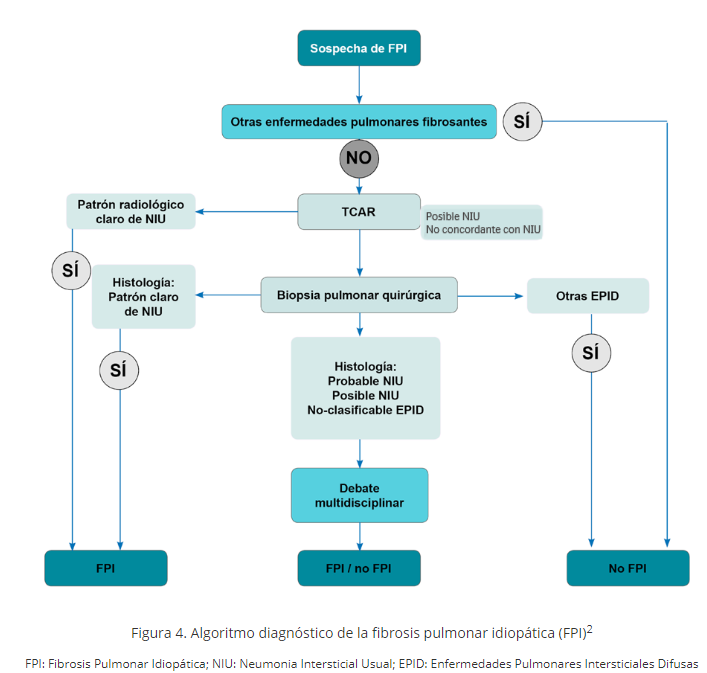
Figura 4. Algoritmo diagnóstico de la fibrosis pulmonar idiopática (FPI)2
FPI: Fibrosis Pulmonar Idiopática; NIU: Neumonia Intersticial Usual; EPID: Enfermedades Pulmonares Intersticiales Difusas
Propuesta de la Fleischner Society para el diagnóstico histopatológico de la fibrosis pulmonar idiopática
La Fleischner Society considera que los criterios para el diagnóstico histopatológico del grupo de consenso internacional1 obvian que un patrón de NIU se encuentra con frecuencia en otras enfermedades, aparte de la FPI. Por eso, proponen una versión revisada de esas guías, en la cual los criterios se relacionan de forma más estrecha con el patrón histopatológico de NIU más específico de los pacientes con FPI (tabla 4).
Tabla 4. Criterios histopatológicos para el diagnóstico de neumonía intersticial usual, según la Fleischner Society
|
Comentarios generales |
NIU-FPI cierta |
|
|
NIU-FPI probable |
|
|
|
NIU-FPI indeterminada |
|
|
|
Características más compatibles con un diagnóstico alternativo |
|
|
|
Criterios específicos |
NIU-FPI cierta |
|
|
NIU-FPI probable |
|
|
|
NIU-FPI indeterminada |
|
|
|
Características más compatibles con un diagnóstico alternativo |
|
NIU-FPI: neumonía intersticial usual de la fibrosis pulmonar idiopática.
Adaptado de Diagnostic criteria for idiopathic pulmonary fibrosis: a Fleischner Society White Paper4.
Biomarcadores de la fibrosis pulmonar idiopática
Se están estudiando diversos marcadores para el diagnóstico, pronóstico y seguimiento de la fibrosis pulmonar idiopática, como el KL-6, las proteínas A y D del surfactante (PS-A y PS-D), las metaloproteinasas 1 y 7, los fibrocitos circulantes, etc. Todavía necesitan validación para su uso rutinario, pero las investigaciones son esperanzadoras.2,16
Diagnóstico diferencial de la fibrosis pulmonar idiopática (FPI)
El diagnóstico diferencial de la fibrosis pulmonar idiopática incluye las siguientes enfermedades3,5:
- Neumonía intersticial inespecífica: es un tipo de neumonía intersticial idiopática en la cual se encuentra una imagen de vidrio deslustrado en la TCAR, a veces con reticularidad y bronquiectasias de tracción, pero, en general, sin patrón en panal de abeja.
- Enfermedades del tejido conectivo: estas enfermedades, pueden mostrar en la TCAR un patrón indistinguible de la NIU, aunque la manifestación radiológica intersticial más frecuente es la de una neumonía intersticial inespecífica. El cuadro clínico es fundamental para el diagnóstico diferencial (afectación articular, fenómeno de Raynaud, alteraciones cutáneas, disfagia, debilidad muscular, etc.).
- NIU por fármacos o radioterapia: una vez más, el cuadro clínico es el que orientará el diagnóstico. Algunos fármacos que producen un patrón de NIU son la fosfomicina, la bleomicina, el metotrexato y la nitrofurantoína.
- Asbestosis: los signos radiológicos e histopatológicos son parecidos, con la diferencia de que la afectación pleural (placas pleurales, engrosamiento pleural difuso) es casi constante en la asbestosis. El diagnóstico definitivo de la asbestosis requiere unos antecedentes laborales compatibles y la presencia de fibras de amianto (en forma de cuerpos ferruginosos) en la muestra de tejido.
- Neumonitis por hipersensibilidad crónica: se parece a la FPI tanto en los datos clínicos como en los radiológicos. En la TCAR suele hallarse fibrosis y un patrón en panal de abeja, que en un 80 % de los casos afecta a la vez a los lóbulos superiores e inferiores. El patrón en panal de abeja preferente en los lóbulos superiores es muy sugerente de neumonitis por hipersensibilidad. También lo es el atrapamiento aéreo en la TCAR en espiración, que muestra un patrón en mosaico y traduce la afectación de la vía aérea distal por bronquiolitis.
La histopatología se caracteriza por fibrosis centrolobulillar y afectación peribronquiolar (a diferencia de la afectación subpleural y periseptal de la FPI). Los granulomas poco formados y las células gigantes en el intersticio son signos típicos, pero raros, de neumonitis por hipersensibilidad.
- Otros: la histiocitosis de células de Langerhans, la combinación de fibrosis pulmonar y enfisema, y la fibroelastosis pleuropulmonar deben también tomarse en cuenta en el diagnóstico diferencial de la FPI.
Referencias
- Raghu G, et al. Diagnosis of Idiopathic Pulmonary Fibrosis. An Official ATS/ERS/JRS/ALAT Clinical Practice Guideline. American Journal of Respiratory and Critical Care Medicine. 2018;198(5), pp.e44-e68.
- Xaubet A, et al. Normativa SEPAR. Normativa sobre el diagnóstico y tratamiento de la fibrosis pulmonar idiopática. Arch Bronconeumol. 2013;49(8):343-53.
- Rodríguez Portal JA. Fibrosis pulmonar idiopática: retos en el diagnóstico y ventajas de un abordaje multidisciplinar. Monogr Arch Bronconeumol. 2015;2(1):1-6.
- Lynch DA, Sverzellati N, Travis WD, et al. Diagnostic criteria for idiopathic pulmonary fibrosis: a Fleischner Society White Paper. Lancet Respir Med. 2018;6(2):138-153.
- Talmadge EK. Clinical manifestations and diagnosis of idiopathic pulmonary fibrosis. UpToDate. 2018.
- Morell F, Villar A. Fibrosis pulmonar idiopática: estudio diagnóstico con 10 actuaciones clínicas. Med Clin (Barc). 2017;149(6):253-255.
- Casan Clarà P, Martínez González C, Ancochea J. Pruebas de función pulmonar en la fibrosis pulmonar idiopática: ¿más allá de la espirometría? Arch Bronconeumol. 2016;52(9):457-458.
- Ancochea Bermúdez J, Alonso Pérez T, Somiedo Gutiérrez MV, et al. Fibrosis pulmonar idiopática. Medicine. 2014;11(64):3799-807.
- Wells AU. Managing diagnostic procedures in idiopathic pulmonary fibrosis. Eur Respir Rev. 2013;22(128):158-62.
- Gruden JF. CT in idiopathic pulmonary fibrosis: diagnosis and beyond. Am J Roentgenol. 2016;206:495-507.
- Brownell R, Moua T, Henry TS, et al. The use of pretest probability increases the value of high-resolution CT in diagnosing usual interstitial pneumonia. Thorax. 2017;72(5):424.
- Salisbury ML, Xia M, Murray S, et al. Predictors of idiopathic pulmonary fibrosis in absence of radiologic honeycombing: A cross sectional analysis in ILD patients undergoing lung tissue sampling. Respir Med. 2016;118:88.
- Bollo de Miguel E. ¿Qué hay de nuevo en la fibrosis pulmonar idiopática? Arch Bronconeumol. 2018;54(1):1- 2.
- Hernández-González F, Lucena CM, Ramírez J, et al. Cryobiopsy in the diagnosis of diffuse interstitial lung disease: Yield andcost-effectiveness analysis. Arch Bronconeumol. 2015;51:261-7.
- Tomassetti S, Wells AU, Costabel U, et al. Bronchoscopic Lung Cryobiopsy Increases Diagnostic Confidence in the Multidisciplinary Diagnosis of Idiopathic Pulmonary Fibrosis. Am J Respir Crit Care Med. 2016;193(7):745.
- Rekha V, Noth I. Peripheral blood biomarkers in idiopathic pulmonary fibrosis. Transl Res. 2012;159(4):218- 27.
ILD.0070.052020
